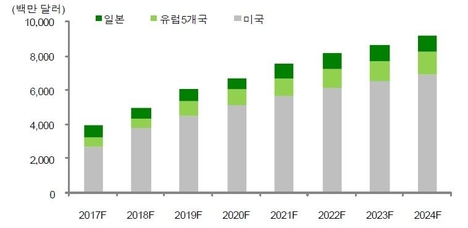
FDA자문 위원, 화이자-릴리 통증 치료제 승인 반대의 뼈 관절염 통증 치료용 신약···이익보다 리스크가 크고 새로운 비 오피오이드 옵션을 갈망하는 미국 식품 의약국(FDA)의 자문 위원회가 파이와 릴리의 뼈 관절염(OA)통증 치료제 타네즈마브(tanezumab)승인에 대해서 부정적인 의견을 제시했다.▲ 화이자와 릴리는 FDA자문 위원회에서 뼈 관절염의 통증 치료제인 타네쥬마브에 대한 긍정적인 권고 의견을 획득하는 데 실패했다.화이자와 릴리는 25일(현지 시간)FDA의 관절염 자문 위원회와 의약품 안전성·위해성 관리 자문 위원회 합동 회의에서 나온 결과를 발표했다.자문 위원회는 회사 측에 의해서 제안된 위험성 평가 완화 전략(REMS)을 통해서 타네쥬마브이 제공하는 혜택이 위험성을 능가할 것인가에 대해서 투표했으나 찬성이 1표, 반대가 19표였다.효능이 크지 않기 때문에 비해서 위험성이 높다고 판단한 것이다.외신 보도에 따르면 자문 위원회 회의에 앞서FDA심사관은 타네즈마브의 임상 시험에서 관찰된 급속 진행 뼈 관절염(RPOA)에 대해서 우려를 제기했다.의약품 및 안전성 문제를 모니터링하기 위해서 제안된 리스크 평가 완화 전략이 RPOA리스크를 완화하는 데 충분치 않다고 간주했다.이 자문 위원회의 논의는 현재 FDA가 검토 중인 생물학적 제제 허가 신청(BLA)을 기반으로 한다.BLA에는 중등도로 중증 뼈 관절염 환자 4,500명 이상을 대상으로 실시된 임상 3상 시험 3건을 포함한 정맥 주사 또는 피하 주사를 통해서 투여된 타네쥬마브의 안전성 및 효능을 평가한 임상 1-3상 시험 20건의 데이터가 포함되어 있다.타네쥬마브은 다른 진통제의 사용이 효과가 없거나 부적합한 성인 환자의 중등도로 중증 뼈 관절염의 통증을 치료하기 때문에 8주마다 2.5mg을 피하 주사하는 용도로 승인 신청됐다.타네쥬마브은 신경 생장 인자(NGF)억제제라는 새로운 종류의 단일 클론 항체에서 마약성 진통제(오피오이드), 비스테로이드 항염증 약(NSAID), 기타 진통제 등 현재 사용 가능한 치료제와 다른 방식으로 작용한다.임상 시험에서 타네쥬마브는 중독, 오용, 의존성의 위험을 보이지 않았다.화이자 글로벌 제품 개발부 타네쥬마브 개발 팀 책임자 켄·바 버그 박사는 “오늘 결과에 실망했지만 타네쥬마브가 현재 치료제가 효과가 없거나 부적합한 중등도로 중증 뼈 관절염의 통증 환자에 대해서 긍정적인 혜택-위험성 프로파일을 가지고 있다고 믿고 있다”고 밝혔다.이어”이런 환자의 대부분은 사용 가능한 치료제를 썼으며 10년 이상 새로운 종류의 의약품을 사용할 수 없었기 때문에, 새로운 비 오피오이드 옵션을 절실히 원하고 있다”며”FDA가 신청서를 계속 검토하는 동안 협력할 방침”이라고 덧붙였다.FDA자문 위원회는 승인 심사 과정에서 외부 의료 전문가의 독립적인 의견과 권고를 FDA에 제공하는 역할을 한다.FDA는 자문 위원회의 의견을 고려하고 최종 결정을 내리지만 꼭 따라야 할 의무는 없다.